空气和氧气
一、空气的组成
1.空气的成分和组成
(1)氮气
通常状况下,氮气是无色、无味的气体,难于水。常温下化学性质稳定。氮气不支持燃烧也不供给呼吸。它是制造硝酸和化肥的 重要原料;根据氮气常温下化学性质稳定,氮气可用作保护气,如焊接金属时常用氮气作保护气,食品包装时充氮气以防腐;医疗上 可用液氮作冷冻剂等。
(2)稀有气体
氦气、氖气、氩气、氪气、氙气、氡气等气体在空气中含量少且化学性质稳定,化学上把它们总称为稀有气体,又称惰性气体。稀有气体通常可用作保护气;稀有气体通电时会发出各种颜色的光,可用作霓虹灯等。
(3)臭氧(O3)
是大气中一种很重要的气体,它的重要性质是抵御紫外线,保护地球上的生物免受紧外线伤害。
2.空气中氧气含量的测定
(1) 实验原理:利用磷燃烧消耗空气中的氧气,从而使容器内形成负压,打开止水夹后,水进入容器内。进入容器中的水的体积,可 粗略地认为是空气中所含氧气的体积。
(2)实验步骤及现象:
①在集气瓶中放入少量水(用于溶解生成的五氧化二磷,同时可吸收燃烧产生的热,有利于瓶内降 温),做上记号,并将瓶内剩余体积均分为五等分。
②用止水夹夹紧乳胶管,点燃燃烧匙内的红磷后,立即伸入集气瓶中并把塞子塞紧。观察到红磷燃 烧,产生浓厚的白烟。
③红磷熄灭后,冷却至室温,打开止不夹,观察到水进入集气瓶内,最终水面在五分之一记号处。
(3)实验结论:
①空气是混合物;
②O2约占 1/5,可支持燃烧;
③其它气体约占 4/5,不支持燃烧,也不能燃烧,难溶于水
(4)实验反思与改进:
①反应物选择及用量:
选择过量的红磷是为了将氧气完全转化为固体物质,形成压强差,水倒流占据氧气体积,便于观察。
如果选择碳或者硫,则会形成气态物质,无法形成压强差,需在右侧烧杯中使用氢氧化钠溶液,可以吸收产物二氧化碳和二氧化 碳,同样可以形成压强差,实验也可以成功;
如果选择铁丝,则由于不能在空气中燃烧而无法消耗氧气,实验无法成功;
镁条呢?然而,由于镁会与氧气、氮气、二氧化碳均发生反应,则最终水倒流占据了三者体积和,显然远大于五分之一,实验无 法成功。
②气密性:
该实验涉及气体体积测量,需在实验开始前进行气密性检查,在实验过程中也需保持气密性良好,红磷需先引燃后放入集气瓶, 插入燃烧匙时,瓶口的气体已经受热膨胀,造成气体逸出,压强差会增大,最终测量结果会偏大。如何改善实验过程呢?
如下图所示,用着火点较低的白磷代替红磷,用聚光、热传递等方式引燃白磷,确保实验过程的气密性良好。
③温度:
温度升高,则气体受热膨胀,压强增大,则瓶内压强与大气压强差值 变小,水流入量偏小,为避免温度对实验的影响,需冷却到室温后打开止水夹。
3.空气的污染及防治:
(1)明确空气质量三大指标:可吸入颗粒物(包含 PM2.5)、二氧化硫、氮氧化合物。只要是有毒气体,均为大气污染气体,如 CO、H2S 等
二氧化硫会造成酸雨,其主要来源是工业上大量燃烧含硫燃料,如煤炭燃烧。
(2)防治:为了使天更蓝,人类正在积极行动,如加强大气质量监测,改善环境状况;使用清洁能源,改善环境状况;积极植树、造林、种 草等,以保护环境。
(3)目前环境污染问题:
臭氧层破坏
温室效应(CO2等)
酸雨(SO2等)
二、氧气的性质
1.氧气的物理性质
常温下,氧气是无色无味的气体,难溶于水,密度比空气略大。
2.氧气
(1)氧气的化学性质:
支持燃烧,供给呼吸。检验氧气:用带火星的木条伸入瓶内,复燃则是氧气。
(2)氧气与很多物质反应现象
注意:
①铁燃烧实验:
需将铁丝绕成螺旋状的目的:增大与空气接触面积,使反应容易发生。
燃烧时需用火柴引燃:提高温度,使其达到铁的着火点。火柴几乎熄灭时插入集气瓶内:防止火柴消耗过多氧气,影响铁丝的燃烧。
要在集气瓶底部放少量水或细砂的目的:防止溅落的高温熔化物 Fe3O4炸裂瓶底。
铁在空气中不可燃烧:氧气浓度越高,可燃物燃烧程度越剧烈。
②硫燃烧实验:
要在集气瓶底部放少量水:吸收二氧化硫,防止污染空气。
碳及其化合物
一、碳的单质
1.碳的同素异形体
说明:无定形碳是混合物,不是碳同素异形体,如木炭、焦炭、活性炭(吸附性)、炭黑。
2.碳的化学性质
化学是一门研究物质的组成、结构、性质以及变化规律的自然科学。
二、碳的氧化物
1.一氧化碳与二氧化碳
2.一氧化碳与碳还原氧化铜的比较
3.碳及其氧化物的转化关系
三、家用燃料
1.燃烧的定义
具有剧烈的发光发热现象的化学反应,称作可燃物的燃烧。
2.燃烧的条件
(1)存在可燃物
(2)可燃物接触助燃剂:最常见的就是空气中的氧气。二氧化碳气体也可作为某活泼金属(例如钠、镁)的助燃剂,如:
现象:剧烈燃烧,发出白光,生成白色粉末和黑色固体)。
(3)温度达到着火点:着火点指可燃物着火燃烧所需的最低温度。
注意:三个条件同时满足才能发生燃烧现象,缺一不可。
3.灭火的原理
消除可燃物或使可燃物与其他物品隔离,隔绝氧气(或空气),以及使温度降到着火点以下,都能达到灭火的目的。
4.燃料的充分燃烧
不间断地鼓入足量的空气(氧气);
增大接触面积,把固体燃料进行粉碎,把液体燃料喷成雾状;
有效改进设备,防止反应热量的散失。
5.常见的家用燃料
天然气:主要成分是甲烷,是一种气体化石燃料。甲烷是一种无色无味的气体,极难溶于水,密度比空气小,所以实验室可以用 排水法或向下排空气法收集。甲烷是一种可燃性气体,点燃前必须先验纯,纯净的甲烷在空气中安静燃烧,火焰呈浅蓝色,生成二氧 化碳和水。燃烧产物无污染,所以天然气是一种清洁(或绿色)能源。
氢能是最理想的绿色能源,理由是来源广泛,燃烧生成水,无污染,燃烧产生的热量多等。
酸碱盐
一、酸
1.酸的组成
酸是仅由氢元素和酸根组成的化合物。
【注意】以下物质不是酸:NaHCO3、H2O
2.酸的分类
①有机酸和无机酸:
常见的无机酸:HCl、HNO3、H2SO4、H2CO3
常见的有机酸:CH3COOH(乙酸)、HCOOH(甲酸)
②无机酸按酸分子中氢原子个数不同,分为:一元酸、二元酸、三元酸。
如:HCl HNO3为一元酸 ;H2SO4 H2CO3为二元酸;H3PO4为三元酸。
有机酸按照 COOH 的个数不同,分为一元酸、二元酸
如:CH3COOH 为一元酸
③按是否含有氧分为:
含氧酸和无氧酸 含氧酸的命名规则为“某酸”:例如 H2CO3命名为碳酸
无氧酸的命名规则为“氢某酸”:例如 H2S 命名为氢硫酸
3.酸的通性:
酸的组成中均含有氢,因此酸具有相似的性质。
①酸溶液与指示剂反应。
②酸 + 活泼金属(活动性顺序表中排在 H 前的金属) → 盐 + H2↑
铁钉和盐酸反应:Fe+2HCl →FeCl2+H2↑ 现象:铁钉溶解,有气泡产生,溶液逐渐变为浅绿色。
【注意】一般采用稀硫酸或者稀盐酸,浓盐酸挥发性太强,产生的氢气中含有大量氯化氢气体,浓硫酸或硝酸与金属反应不产生氢气。
③酸与某些盐反应:
(1)与碳酸盐、碳酸氢盐反应生成二氧化碳:
实验室制取二氧化碳:CaCO3+2HCl → CaCl2+H2O+CO2↑实验现象:有气泡产生
小苏打可以缓解胃酸过多:NaHCO3+HCl→NaCl+H2O+CO2↑
(2)与一些盐反应生成沉淀:
用氯化钡溶液检验硫酸:BaCl2+H2SO4→ BaSO4↓+2HCl 实验现象是:有白色沉淀产生
用硝酸银溶液检验盐酸:AgNO3+HCl → HNO3+AgCl↓ 实验现象是:有白色沉淀产生
④ 中和反应:酸 + 碱 → 盐 + 水
(1)定义:酸和碱反应,生成盐和水并放出热量的反应称为中和反应。
如:3HCl + Fe(OH)3 → FeCl3 + 3H2O实验现象是:红褐色沉淀逐渐溶解,溶液变为棕黄色。
H2SO4 + 2NaOH → Na2SO4 + 2H2O无法观察到明显现象。
(2)中和过程中温度和 pH 变化
以将稀硫酸注入氢氧化钠溶液为例:
(3)中和反应的应用:
Ca(OH)2:改良酸性土壤。
Mg(OH)2、Al (OH)3:治疗胃酸过多。
⑤ 酸 + 金属氧化物 → 盐 + 水
碱性氧化物定义:像氧化铁、氧化铜,能跟酸反应生成盐和水的氧化物叫做碱性氧化物。大多数金属氧化物是碱性氧化物。
稀盐酸或稀硫酸除铁锈:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
实验现象:锈逐渐减少,溶液由无色变成黄色
黑色的氧化铜跟稀盐酸或稀硫酸反应:
CuO + 2HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
实验现象是:黑色的固体逐渐溶解,溶液由无色变成蓝色。
4.常见的酸
①盐酸
(1)盐酸的物理性质:
盐酸是无色透明的液体,有刺激性气味,具有挥发性。
【注意】纯净的盐酸为无色液体,工业盐酸因含FeCl3而显黄色。
(2)挥发性:
盐酸浓度越大,挥发性越强。浓盐酸瓶口出现白雾,这是由于挥发出来的氯化氢气体与空气中的水蒸气接触,又形成盐酸小液滴 的缘故。
盐酸具有挥发性,所以实验室必须密封保存,敞口放在空气中,溶质质量减小,溶液浓度会变小。
②硫酸
(1)物理性质:
纯净的硫酸是无色、粘稠、油状的液体,不 易挥发,易溶于水并放出大量的热。
浓硫酸稀释时,需把浓 H2SO4沿容器壁慢慢注入水中且边倒边搅拌,切不可将水倒入浓硫酸。
皮肤上沾上浓硫酸,先用棉布吸去酸,后用清水冲洗,再用 3%~5%的小苏打溶液冲洗
(2)吸水性:
浓硫酸吸收空气中的水蒸气,使溶质的质量分数减小,没有生成新物质,是物理变化。由于浓硫酸具有吸水性,所以实验室必须 密封保存。
利用浓硫酸具有吸水性,在实验室可以用作干燥剂,除碱性的氨气不可以,几乎可以干燥所有的气体。
(3)脱水性:
原物质中没有水,将原物质中的氢、氧两种元素按水的组成比(2:1)脱去,是化学变化。
浓硫酸点到 pH 试纸上,试纸变成黑色,因此无法用 pH 试纸检测浓硫酸酸碱度。
二、常见的碱
1.碱的组成:
碱是仅由金属元素(或铵根)和氢氧根组成的化合物。
2.碱的分类
按照溶解性:
可溶性碱:NaOH,KOH,Ba(OH)2,Ca(OH)2,NH3·H2O
难溶性碱:其余的碱,如:Cu(OH)2、Fe(OH)3
按照碱性强弱:
强碱:NaOH,KOH,Ba(OH)2,Ca(OH)2
弱碱:其余的碱,如 NH3·H2O
3.碱的通性
① 碱溶液能使指示剂变色:
碱溶液使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
② 与非金属氧化物反应生成盐和水
酸性氧化物:像二氧化碳、二氧化硫等能跟碱溶液反应生成盐和水的氧化物叫做酸性氧化物。非金属氧化物大多是酸性氧化物。
2NaOH + CO2 → Na2CO3 + H2O (NaOH 应密封保存)
2NaOH + SO2 → Na2SO3 + H2O
③ 与酸发生中和反应
2NaOH + H2SO4 → Na2SO4 + 2H2O
④ 与某些盐反应
FeCl3 + 3NaOH → Fe(OH)3↓+ 3NaCl(NaOH 常用于制不溶性碱)
4.常见的碱
① 氢氧化钠与氢氧化钙
②Cu(OH)2:蓝色粉末固体,难溶于水。
③Fe(OH)3:红褐色同体,难溶于水。
三、盐
1.盐的组成:
盐是由金属元素(或铵根)和酸根组成的化合物。
2.盐的分类和命名:
① 分类
正盐:只由金属元素(或铵根)和酸根组成的盐。
如:NaCl、K2SO4
酸式盐:金属元素(或铵根)和酸式酸根组成的盐。
如:NaHCO3、KHSO4、NaHS
复盐,如:KAl(SO4)2
,读作“硫酸铝钾”。
② 命名
含有相同的酸根:某酸盐。
如含硫酸根的盐(CuSO4、K2SO4、CaSO4等)统称为“硫酸盐”
含有相同的金属元素:某盐。如含K元素的盐(KCl、K2SO4、K2CO3等)统称为“钾盐”
3.盐的溶解性
溶解性口诀:
钾钠铵硝四盐皆可溶;
硫酸盐中钡不溶;(硫酸钙,硫酸银微溶)
盐酸盐中银不溶;
碳酸盐只溶钾钠铵。
其中硫酸钡、氯化银超级难溶,既不溶于水也不溶于酸
【记忆技巧】
常见八个沉淀:
4. 盐溶液的颜色
无色——多数
蓝色:铜盐溶液——CuCl2、CuSO4、Cu(NO3)2
浅绿色:亚铁盐溶液——FeCl2、FeSO4、Fe(NO3)2
黄色:铁盐溶液——FeCl3、Fe2(SO4)3、Fe(NO3)3
5. 盐的通性
① 金属+盐溶液→新金属+新盐
条件:前换后(K、Ca、Na除外)、盐必溶;混合盐溶液中,间隔大先进行
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
② 酸+某些盐→酸+盐
条件:生成气体或者沉淀
HCl+AgNO3→HNO3+AgCl↓(检验盐酸盐)
H2SO4+BaCl2→2HCl+Ba2SO4↓检验硫酸盐)
2HCl +CaCO3→CaCl2+H2O+CO2↑(实验室制CO2)
③ 碱+盐→新碱+新盐
条件:可溶性碱和可溶性盐生成难溶性物质或弱碱
Ca(OH)2+Na2CO3→CaCO3↓+2NaOH
2NaOH+CuSO4→Na2SO4+ Cu(OH)2↓
④ 盐+盐→新盐+新盐
条件:两种可溶性盐生成一种或两种难溶性盐
2AgNO3+BaCl2→Ba(NO3)2+2AgCl↓
Na2CO3+CaCl2→2NaCl+CaCO3↓
四、金属
1.金属的物理性质
2.金属的化学性质
(1)金属与酸的置换反应
在金属活动性顺序里,只有排在氢前面的金属才能置换出酸中的氢。
如:Zn+ H2SO4(稀)→ZnSO4+H2↑,Mg + 2HCl → MgCl2 + H2↑
(2)金属与盐溶液的置换反应
在金属活动性顺序里,排在前面的金属(K、Ca、Na 除外)能把排在后面的金属从其盐溶液中置换出来,且盐必须溶于水,否则不反应。
【注意】
①活泼金属与酸反应时,酸一般指的是稀盐酸或稀硫酸,当金属与浓硫酸或硝酸反应时,不产生 H2。
②用金属跟盐溶液发生反应时,一般不用很活泼的 K、Ca、Na 等,因为这些金属常温下和水发生反应,而不能置换出盐溶液里的金属。
③Fe 参加与酸或盐溶液的置换反应时,生成物中铁元素为+2 价,不可写成+3 价铁的化合物。
④设计实验验证金属活动性顺序时,如果从与酸反应的剧烈程度来判断,则要按控制变量的方式保证金属大小与薄厚相同,表面氧化 膜都要用砂纸打掉,且所选择的酸的浓度、体积、温度都一样。如果从前置换后的角度来比较,可选择依次置换的方式来进行。
3.金属的冶炼
一氧化碳炼铁的原理:
实验室中一氧化碳与氧化铁反应的装置:
实验中产生的现象主要有哪三点:红棕色的氧化铁粉末逐渐变成黑色,同时澄清的石灰水逐渐变浑浊,尾气燃 烧并产生淡蓝色火焰。
4.金属活动性强弱
在金属活动性顺序中,排在氢前面的金属能置换出稀盐酸或稀硫酸中的氢,排在氢后面的金属不能置换出稀盐酸或稀硫酸中的氢。只有排在前面的金属,才能把排在后面的金属从它们的盐溶液中置换出来。
【注意】金属活动性顺序可采用“五元素一句”的方法记忆,即“钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金”。
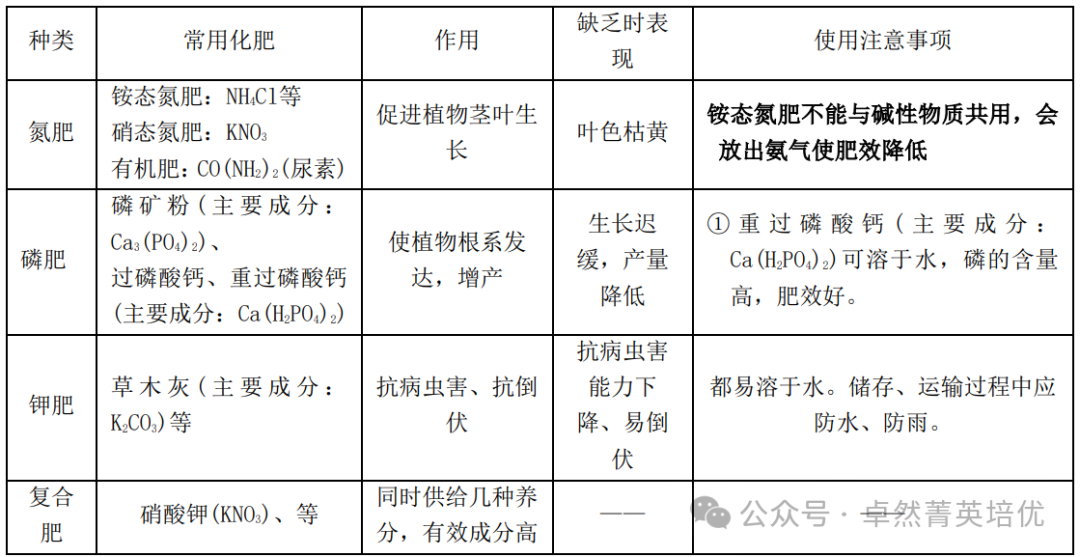
五、化肥